1. Si la charge négative augmente, la nucléophilie augmente

2.Au plus l'élément est à droite du tableau périodique, au plus la nucléophilie est faible
3. Au plus l'élément est bas dans le tableau périodique, au plus la nucléophilie augmente
Cl- < Br- < I-
En résumé on constate que la nucléophilie est inverse à l'électronégativité. Il ne faut pas oublier qu'un nucléophile doit donner des électrons pour "attaquer" et former une liaison. Intuitivement on peut comprendre qu'un élément très électronégatif comme F- n'a aucune envie de donner ses électrons et est donc un mauvais nucléophile.
| Nucléophile | ||||
|---|---|---|---|---|
| Haloalcane | Mauvais nucléophile (ex. H2O) |
Bon nucléophile Base faible (ex. I-) |
Bon nucléophile Fortement basique Peu encombré |
Bon nucléophile Fortement basique Encombré |
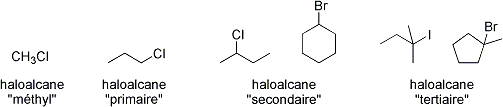
| méthyl | pas de réaction | SN2 | SN2 | SN2 |
| primaire | pas de réaction | SN2 | SN2 / E2 | E2 |
| secondaire | SN1, E1 (lent) | SN2 | E2 | E2 |
| tertiaire | SN1, E1 | SN1, E1 | E2 | E2 |