OH est un mauvais nucléofuge (groupement partant). Au moins un groupement est basique (il n'a pas envie de capturer un H+), au plus il est nucléofuge.
Souvent on transforme le groupement OH en bon nucléofuge. Ceci permet de diminuer l'énergie de l'état de transition (on stabilise l'état de transition).
Exemple :
![]()
Avec un acide non nucléophile, élimination favorisée.

Dans cet exemple E1 (car il n'y a pas de base).
Métaux alcalins (Li, Na, K) réagissent avec les alcools comme avec l'eau (libération d'hydrogène) pour former les alcoolates.
![]()
Utilisation des alcoolates dans les SN et E. Ce sont à la fois des bons nucléophiles mais également des bases fortes.
Parmi les bases fortes encombrées on citera tBuONa (tert-butanolate de sodium). Celui-ci donnera presque exclusivement des éliminations de type E2.
L'étage d'oxydation (E.O.) d'un atome est la charge formelle que porte cet atome, lorsque, dans chaque liaison où il intervient, on attribue une charge négative à l'atome le plus électronégatif et une charge positive à l'autre.
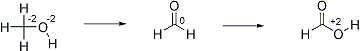
L'EO du carbone augmente -> nous avons une réaction d'oxydation.

Au départ d'alcools primaires, dans la plupart des cas oxydation jusqu'à l'acide.
![]()
![]()
Exemple :
![]()